Insbesondere Pilze und Pflanzen und Mikroorganismen produzieren eine enorme Vielfalt an chemischen Verbindungen, die nicht für ihr unmittelbares Überleben notwendig sind – die Sekundärmetabolite. Zwar konnte für einige gezeigt werden, dass sie als Antibiotika, Abwehrstoffe oder Pheromone fungieren, jedoch ist die Funktion für die Mehrheit dieser Stoffe unklar geblieben. Um ein tieferes Verständnis des Sekundärmetabolismus entwickeln zu können und damit auch einen Zugang zu neuen Wirkstoffen eröffnen zu können, ist es notwendig, sich mit den zugehörigen Biosyntheseprozessen auseinanderzusetzen. Im letzten Jahrhundert konnte über Isotopen-Markierungsexperimente gezeigt werden, dass die Sekundärmetabolite aus nur wenigen Bausteinen des zusammengesetzt werden (oft Acetat, Aminosäuren, Isopren oder Shikimat), die dann in vielfältiger Art modifiziert werden. Die Natur spielt also „chemisches Lego“, indem ein begrenztes Repertoir an Bausteinen über eine begrenzte Zahl von Basisregeln kombiniert werden können, so dass eine große chemische Vielfalt entsteht. Eine besondere Rolle kommt dabei Biosyntheseschritten zu, die Biodiversität erzeugen. Sie stellen Verzweigungspunkte in der Biosynthese dar. Die Forschung im Labor von ALUF-MedPharm (Universität Freiburg, Pharmazeutisches Institut, Prof. Dr. Michael Müller) zielt auf die Aufklärung von Biosyntheseschritten ab, die mit chemischen Methoden nur schwer durchführbar sind. Ein besonderes Augenmerk gilt dabei der Erzeugung metabolischer Diversität und damit der biokatalytischen Erschließung ganzer Substanzgruppen.
Ein Beispiel dafür ist die Enzym-katalysierte oxidative Phenolkupplung, bei der aus identischen Monomeren verschiedene Dimere entstehen können (Abb. 1). Noch zur Jahrtausendwende waren die zugrundeliegenden Enzyme weitgehend unbekannt. Insbesondere durch die Möglichkeit der Genomanalyse ist es uns und anderen Gruppen seitdem gelungen, eine Reihe von phenolkuppelnden Enzymen zu identifizieren und (teilweise) zu beschreiben.
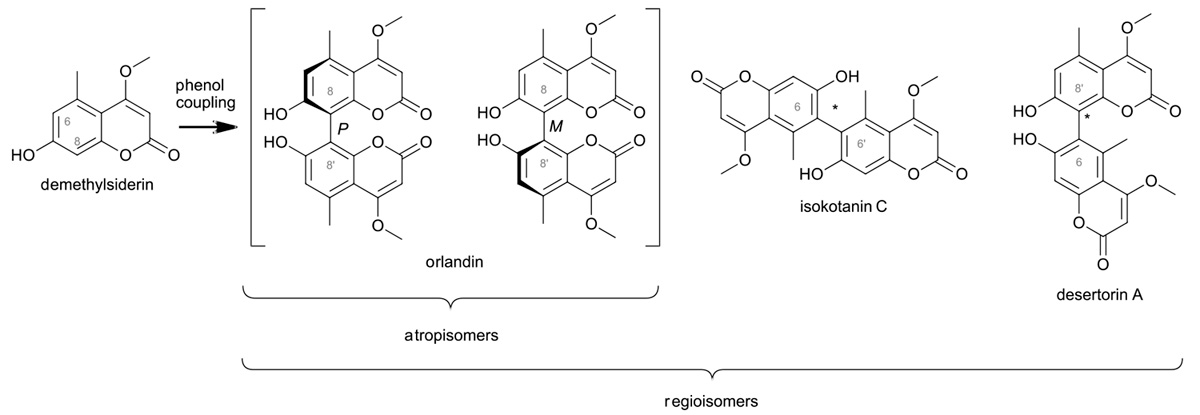
Abb. 1: Enzym-katalysierte oxidative Phenolkupplung
Dabei zeigt sich, dass Phenolkupplungen von verschiedenen Oxidationssystemen, vor allem Cytochrom-P450-Enzymen und Laccasen, aber auch von Peroxidasen und möglicherweise von Flavin-abhängigen Oxidasen katalysiert werden. Manche dieser Enzyme sind strikt substratspezifisch, andere (durchaus auch nah verwandte) Enzyme frönen dagegen der Promiskuität und akzeptieren mehrere Substrate. Dabei kann es von zusätzlichen Proteinen oder von den Reaktionsbedingungen abhängen, welche Reaktion katalysiert wird.
Vor diesem Hintergrund soll im Rahmen dieses Projekts versucht werden, aus aktiven Pilzextrakten die verantwortlichen Moleküle mithilfe aktivitätsgeleiteter Fraktionierung zu identifizieren und danach die chemische Struktur lösen. Interessant sind hierbei auch die NADPH-abhängigen Oxidoreduktasen, die für die Synthese von Polyketiden, einer zentralen Gruppe pilzlicher Sekundärmetaboliten, verantwortlich sind. Dann sollen entweder diese Zielkomponenten oder deren über das oben beschriebene «chemische Lego» erzeugte Varianten über chemische Synthese oder Hemisynthese erzeugt werden, um genügend Material für die funktionellen Tests zu erhalten. Ebenfalls besteht die Option, diese Modularität auf der Ebene der Molekülsynthese mit der Modularität des Chip-Systems zu verbinden, also chemische Reaktionswege von Interesse auf einer mikrofluidische Plattform nachzubilden.
Literaturquelle
L. Fürtges, S. Obermaier, W. Thiele, S. Foegen and M. Müller, Diversity in Fungal Intermolecular Phenol Coupling of Polyketides – Regioselective Laccase‐based systems. ChemBioChem, 2019, 20, 1928–1932. doi.org/10.1002/cbic.201900041.
S. Obermaier and M. Müller, Biaryl-Forming Enzymes from Aspergilli Exhibit Substrate-Dependent Stereoselectivity, Biochemistry, 2019, 58, 2589–2593. doi.org/10.1002/chem.201705998
S. Obermaier, W. Thiele, L. Fürtges and M. Müller, Enantioselective Phenol Coupling by Laccases in the Biosynthesis of Fungal Dimeric Naphthopyrones. Angew. Chem. 2019, 58, 9125–9128. doi.org/10.1002/anie.201903759.
